涉55个品种,第十一批国采启动
发布时间:2025-09-24 17:22:51 阅读量:877
作者:医药健康资讯 来源:医药健康资讯
核心提示:国家组织药品联合采购办公室发布《全国药品集中采购文件(GY-YD2025-1)》的公告。

近日,国家组织药品联合采购办公室发布《全国药品集中采购文件(GY-YD2025-1)》的公告。(点击“阅读原文”查看)
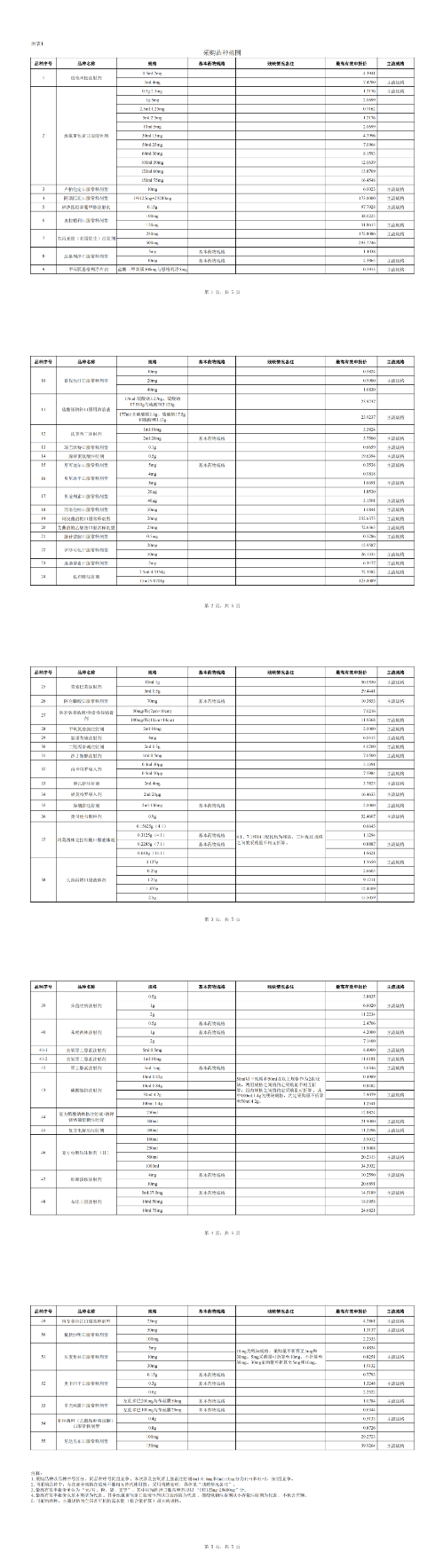
根据梳理,纳入第十一批集采的药品涉及倍他米松注射剂、地氯雷他定口服液体剂等55个品种(详见附件)。各品种各地采购周期自中选结果执行之日起至2028年12月 31 日。

申报品种资格
属于采购品种范围,在 2025 年9 月28 日(含)前获得国内有效注册批件,并须在“国家医保服务平台”(fuwu.nhsa.gov.cn)按照“六、基础信息填报截止时间”的要求填报药品信息。未在“国家医保服务平台”填报信息的药品无法参与本次申报。申报药品应满足以下要求之一,并具备相应批件或可在国家药品监督管理局药品审评中心《化学药品目录集》中查询到相应结果:
1.国家药品监督管理部门发布的仿制药质量和疗效一致性评价参比制剂。
2.通过国家药品监督管理部门仿制药质量和疗效一致性评价的仿制药品。
3.根据《国家食品药品监督管理总局关于发布化学药品注册分类改革工作方案的公告》〔2016 年第 51 号〕或《国家药监局关于发布化学药品注册分类及申报资料要求的通告》〔2020 年第44号〕,按化学药品注册分类批准,并证明质量和疗效与参比制剂一致的仿制药品。
满足上述要求的申报药品,须同时满足以下三条资质要求:
1.申报药品的药品上市许可持有人或受委托生产企业有同类型制剂生产经验,需提供同类型制剂 5 年以内的上市放行记录或国内销售证明(提供 2020 年 9 月至 2025 年9 月任意2 个时间点的相关材料,且材料时间跨度在 24 个月以上)。
2.申报药品已通过上市前的药品生产质量管理规范(GMP)符合性检查,需提供药监部门发放或公布的GMP 符合性检查相关证明材料,进口药品可提供境外药监部门 GMP 符合性相关证明材料。若申报药品 GMP 符合性检查相关证明材料不在有效期内,同时提供同类型制剂的最近一次 GMP 符合性检查结果。若GMP 符合性检查相关证明材料未载明具体药品名称,须同时承诺申报药品在已通过GMP符合性检查的生产线上生产(附件 8),并提供相关佐证材料(如批生产记录、情况说明等)。
3.申报药品的生产线 2 年内(2023 年9 月至2025 年9月)不存在不符合药品生产质量管理规范(GMP)要求的情形。申报药品在本次药品集中采购活动 2 年内不存在省级(含)以上药品监督管理部门质量检验不合格情况(其中涉及的仿制药是指通过国家药品监督管理部门仿制药质量和疗效一致性评价上市后出现上述情况的)。
拟中选企业确定
11.入围企业确定准则
同品种入围企业根据最多入围企业数及申报企业顺位确定。
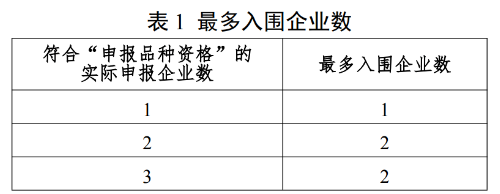
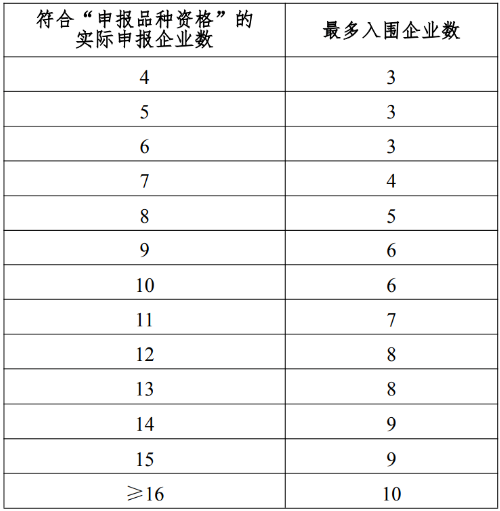
11.1 采购品种范围内同品种最多入围企业数根据符合“申报品种资格”的实际申报企业数确定,见表1。
11.2 以采购品种范围内同品种主流规格(即全国首年机构需求量(按含量折算)最大的规格)作为代表规格,参照药品差比价规则折算至最小计量单位后的价格作为“单位可比价”。按“单位可比价”由低到高确定申报企业顺位。“单位可比价”最低的为第一顺位,次低的为第二顺位,依次类推确定其他顺位。
11.3 同品种申报企业“单位可比价”相同时,按以下规则依次确定:
(1)当前未被任意一省依据医药价格和招采信用评价制度评定为“严重失信”或“特别严重失信”的企业优先。
(2)全国首年机构需求量(按含量折算)大的企业优先。
(3)国家药品监督管理部门发布的仿制药质量和疗效一致性评价参比制剂优先。
(4)申报药品 2 年内(2023 年9 月至2025 年9 月)未发生如下变更情形的企业优先(其中涉及的仿制药是指通过国家药品监督管理部门仿制药质量和疗效一致性评价上市后):①由自行生产变更为委托生产,或者变更受委托生产企业;②生产工艺、生产批量、原料药、主要药用辅料、主要药品包装材料发生重大变更情形。
(5)通过或视同通过国家药品监督管理部门仿制药质量和疗效一致性评价时间在前的企业优先(以国家药品监督管理部门批准日期为准)。
(6)原料药自产的企业优先(限指原料药和制剂生产企业为同一法人)。
(7)承诺供应国内市场产能更大的企业优先(产能以企业在“国家医保服务平台”中承诺且提交的产能为依据)。
拟中选企业确定准则
各品种有效申报企业按照以下规则依次确定拟中选企业。
规则一:有效申报入围企业价格符合以下条款之一,获得拟中选资格。
“单位可比价”≤同品种“锚点价格”1.8 倍的。锚点价格为有效申报入围企业“单位可比价”平均值的50%、最低“单位可比价”二者取高值。实际申报企业数为1 家和2 家的,“单位申报价”相比最高有效申报价降幅达到或超过其他拟中选品种(含规则一、二、三)平均降幅的 50%。
本次口服固体制剂(含泡腾片)“单位可比价”≤0.1元、小容量注射剂“单位可比价”≤1 元、大容量注射液“单位可比价”≤2 元的。
规则二:按规则一未获得拟中选资格的有效申报入围企业,若接受按规则一确定的同品种最高拟中选价格,则可获得拟中选资格;如按规则一拟中选的企业只有 1 家,同品种入围企业接受“锚点价格”的 1.8 倍,则可获得拟中选资格。同品种实际申报企业数为 1 家和2 家、且按规则一未获得拟中选资格的企业,若接受“单位申报价”相比最高有效申报价降幅达到或超过其他拟中选品种(含规则一、二、三)平均降幅的50%,则可获得拟中选资格,视同按规则二拟中选。
规则三:同时满足以下条件的有效申报但未入围企业,可获得拟中选资格,根据拟中选价格获得一定比例的首年机构需求量(详见第 19 条款表 1):
①本厂牌首年机构需求量达到或超过同品种有首年机构需求量的各厂牌平均值(申报时视同为 1 家的企业,计算前述平均值时厂牌数计为 1;以联合体申报的,需求量合并计算);②非同品种最高顺位;
③接受以下价格之一,包括不高于同品种按规则一和规则二确定的最高拟中选价格,或不高于按规则一和规则二确定的最高拟中选价格和“锚点价格”的平均值,或不高于“锚点价格”。
拟中选企业顺位按首次申报价,依据11.2 和11.3 条款确定。
以联合体申报拟中选的,涉及企业均视为获得拟中选资格,执行同一中选价格。
中选药品确定
拟中选结果公示
拟中选结果在“上海阳光医药采购网”(www.smpaa.cn)公示,并接受申投诉。申投诉应在公示期间提出,并依法依规提供合法有效证据材料;未提供相应证据材料或公示期结束后提出申投诉的,联合采购办公室原则上不予受理。经公示,如拟中选企业被取消中选资格的,所涉品种不递补拟中选企业。
同品种“单位可比价”低于“锚点价格”的拟中选企业,在拟中选结果公示期间提交“报价合理性声明”(附件11),联合采购办公室将公布相关声明。公示期间,未提交相关声明的,取消中选资格,并列入“违规名单”。
拟中选企业被取消中选资格的,所涉约定采购量由同品种其他中选企业获得,参照 13.2 条款选择供应地区。
中选通知
拟中选结果公示无异议后,联合采购办公室发布中选通知。
附表1 采购品种范围